Tα άτομα δομούνται με τέτοιο τρόπο έτσι ώστε να έχουν την μικρότερη ενέργεια και συνεπώς την μέγιστη δυνατή σταθερότητα.
Σύμφωνα με τον μνημονικό κανόνα για την συμπλήρωση των υποστιβάδων (το κλασσικό σχεδιάκι που τραβάμε τις γραμμές διαγώνια, υπάρχει στο βιβλίο στη σελίδα 15), η υποστιβάδα 4s έχει χαμηλότερη ενέργεια απ την υποστιβάδα 3d που συμπληρώνεται στη συνέχεια. Όταν όμως μπει
έστω και ένα ηλεκτρόνιο σε υποστιβάδα 3d, αλλάζουν οι απώσεις μεταξύ των ηλεκτρονίων, οπότε αυτή αποκτά χαμηλότερη ενέργεια απ την υποστιβάδα 4s.
Έτσι, όταν γράφουμε την ηλεκτρονιακή δόμη του ατόμου πρώτα γράφουμε την υποστιβάδα 3d και μετά την 4s.
Ανάλογα γίνεται και η δόμηση σε υποστιβάδες ns, (n-1)d και (n-2)f.
Πχ.
Το στοιχείο Ti με ατομικό αριθμό 22. Η δόμηση του έχει ως εξής:
Αρχικά:
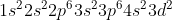
Όμως αφού μπαίνουν ηλεκτρόνια στην υποστιβάδα 3d η σωστή δόμηση θα είναι:
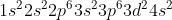
Ειδική περίπτωση:
Όταν κατά την ηλεκτρονιακή δόμηση προκύψει
d^4 ns^2)
, δηλαδή έχει 4 ηλεκτρόνια σε d τροχιακό, τότε θα φύγει το ένα ηλεκτρόνιο απ την υποστιβάδα ns και θα πάει στην υποστιβάδα (n-1)d για να ημισυμπληρωθεί.
Το ίδιο συμβαίνει και όταν έχουμε υποστιβάδα d με 9 ηλεκτρόνια. Φεύγει το ένα απ την στιβάδα s που ακολουθεί και συμπληρώνει 10.
Πχ: το στοιχείο Cu με ατομικό αριθμό 29. Έχει ηλεκτρονιακή δόμηση:
Αρχικά:
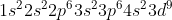
Επειδή έχουν μπει ηλεκτρόνια στην υποστιβάδα 3d αυτή θα αποκτήσει χαμηλότερη ενέργεια απ την 4s,δηλαδή η δομή θα είναι:
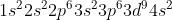
Βλέπεις δηλαδή ότι πρόκειται για περίπτωση με υποστιβάδα d που έχει 9 ηλεκτρόνια. Άρα θα φύγει το ένα απ την εξωτερική (4s) και θα συμπληρώσει την υποστιβάδα 3d. Δηλαδή η τελική δόμηση θα είναι:
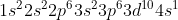 ΠΡΟΣΟΧΗ:
ΠΡΟΣΟΧΗ: Όταν γίνεται δόμηση κατιόντος σε στοιχεία που έχουν ηλεκτρόνια σε υποστιβάδες d τότε τα ηλεκτρόνια που αφαιρούνται, αφαιρούνται πρώτα απ την εξωτερική στιβάδα ns και μετά απ την (n-1)d.
Πχ στο στοιχείο που δομήσαμε παραπάνω, το Τi:
Τi+ Γράφουμε την ηλεκτρονιακή δόμηση του στοιχείου στην θεμελιώδη κατάσταση: Αρχικά
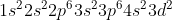
όπως είπαμε όμως γράφεται:
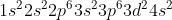
Κι εσύ θες το Ti+: Θα αφαιρέσεις ένα ηλεκτρόνιο απ την εξωτερική στιβάδα, δηλαδή απ την 4s:
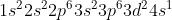
Ελπίζω να βοήθησα,σόρρυ για το μεγάλο μήνυμα προσπάθησα μόνο να τα κάνω πιο κατανοητά.
