vimaproto
Πολύ δραστήριο μέλος


Την πρώτη αντίδραση δεν την γνωρίζω. Ξέρω ότι το αιθίνιο αντιδρά με νερό παρουσία Η2SO4, HgSO4 και δίνει αιθανάλη (ακεταλδεύδη) την οποία οξειδώνω και δίνει αιθανικό οξύ (οξικό) ενώ τα άλλα αλκένια δίνουν κετόνες οι οποίες στη συνέχεια δεν οξειδώνονταιέτσι είναι σωστά?
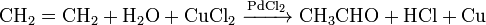
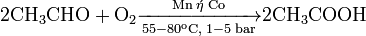
Αφού θέλω οξύ γιατί να μη φτιάξω αλκοόλη και να την οξειδώσω?
Προηγουμένως στο αλκένιο εφαρμόζω Μαρκόβνικωφ προσθέτοντας νερό σε όξινο περιβάλλον και από το αιθένιο παίρνω αιθανόλη , ενώ από τα άλλα αλκένια παίρνω δευτεροταγή ή τριτοταγή αλκοόλη.
Σημείωση: Το μήνυμα αυτό γράφτηκε 11 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Xaris SSSS
Διάσημο μέλος


Την πρώτη αντίδραση δεν την γνωρίζω. Ξέρω ότι το αιθίνιο αντιδρά με νερό παρουσία Η2SO4, HgSO4 και δίνει αιθανάλη (ακεταλδεύδη) την οποία οξειδώνω και δίνει αιθανικό οξύ (οξικό) ενώ τα άλλα αλκένια δίνουν κετόνες οι οποίες στη συνέχεια δεν οξειδώνονται
Αφού θέλω οξύ γιατί να μη φτιάξω αλκοόλη και να την οξειδώσω?
Προηγουμένως στο αλκένιο εφαρμόζω Μαρκόβνικωφ προσθέτοντας νερό σε όξινο περιβάλλον και από το αιθένιο παίρνω αιθανόλη , ενώ από τα άλλα αλκένια παίρνω δευτεροταγή ή τριτοταγή αλκοόλη.
Ναι όντως η οξείδωση αλκοόλης είναι πολύ πιο γρήγορη διαδικασία. Τον άλλο τρόπο τον βρήκα στις παρασκευές αιθανικού οξέος εδώ και ρώτησα για να καταλάβω την λογική
Σημείωση: Το μήνυμα αυτό γράφτηκε 11 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
vimaproto
Πολύ δραστήριο μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 11 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.



Μεταλλικό νάτριο επιδρά σε μια κορεσμένη μονοσθενής αλκόολη οπότε ελκύεραι υδρογόνο από 13,22gr της αλκόολης παίρνουμε 2L υδρογόνου μετρημένα σε STP. Nα βρείτε:
Α) το μοριακό τύπο της αλκόολης
Β) το συντακτικό τύπο εάν γνωρίζετε ότι η αλκόολη αυτή δεν οξυδώνεται
Αrc=12, ArH=1, ArO=16
Σημείωση: Το μήνυμα αυτό γράφτηκε 11 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Dias
Επιφανές μέλος


Τι μου θύμισες τώρα μαμάκα μου!!! (Για να δω αν δεν τα έχω ξεχάσει).Παιδάκια...βοήθεια!
Μεταλλικό νάτριο επιδρά σε μια κορεσμένη μονοσθενή αλκόολη οπότε εκλύεται υδρογόνο. Από 13,22gr της αλκόολης παίρνουμε 2L υδρογόνου μετρημένα σε STP. Nα βρείτε:
Α) το μοριακό τύπο της αλκόολης
Β) το συντακτικό τύπο εάν γνωρίζετε ότι η αλκόολη αυτή δεν οξειδώνεται
Αrc=12, ArH=1, ArO=16
CνΗ2ν+1ΟΗ + Νa ---> CνΗ2ν+1ΟΝa + ½Η2
(14ν + 18 )g . . . . . . . . . . . . . . . . . . . 11,2L
. . 13,22g . . . . . . . . . . . . . . . . . . . . . . 2L
Αναλογία => ν = 4 , άρα C4H9OH (βουτανόλη)
Αφού δεν οξειδώνεται => τριτοταγής (μεθυλο-2-προπανόλη)
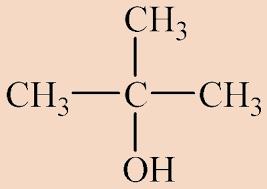
Σημείωση: Το μήνυμα αυτό γράφτηκε 11 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.


Τι μου θύμισες τώρα μαμάκα μου!!! (Για να δω αν δεν τα έχω ξεχάσει).
CνΗ2ν+1ΟΗ + Νa ---> CνΗ2ν+1ΟΝa + ½Η2
(14ν + 18 )g . . . . . . . . . . . . . . . . . . . 11,2L
. . 13,22g . . . . . . . . . . . . . . . . . . . . . . 2L
Αναλογία => ν = 4 , άρα C4H9OH (βουτανόλη)
Αφού δεν οξειδώνεται => τριτοταγής (μεθυλο-2-προπανόλη)

Σε ευχαριστώ πολύ!!!!!



Σημείωση: Το μήνυμα αυτό γράφτηκε 11 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Τυφών
Εκκολαπτόμενο μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 10 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Τυφών
Εκκολαπτόμενο μέλος


64 Μίγμα όγκου 15 mL που αποτελείται από μεθάνιο και προπένιο αναφλέγεται με οξυγόνο. Μετά τη ψύξη των αερίων της καύσης στη συνήθη θερμοκρασία, βρίσκουμε ότι ο όγκος του αερίου που δεσμεύθηκε από διάλυμα NaOH είναι 35 mL. Αν οι όγκοι μετρήθηκαν στις
ίδιες συνθήκες θερμοκρασίας και πίεσης, να προσδιοριστεί η κατ' όγκον σύσταση του μίγματος των δύο υδρογονανθράκων.
65 Καίγονται 12 mL μίγματος αιθινίου και ενός υδρογονάνθρακα της ομόλογης σειράς των αλκανίων με 60 mL oξυγόνου. Μετά την καύση και την ψύξη των προϊόντων της καύσης στη συνήθη θερμοκρασία, απομένουν 51 mL, από τα οποία τα 26 mL δεσμεύτηκαν από διάλυμα βάσης. Να βρεθούν:
α) η κατ' όγκο σύσταση του μίγματος των δύο υδρογονανθράκων αν οι όγκοι μετρήθηκαν στις ίδιες συνθήκες θερμοκρασίας και πίεσης.
β) ο μοριακός τύπος του αλκανίου.
66.
10 mL αλκενίου υφίστανται πλήρη υδρογόνωση με 12 mL Η2 και μετατρέπονται σε αλκάνιο. Το μίγμα των αερίων που προκύπτει απαιτεί για την πλήρη καύση του 66 mL O2. Να βρεθεί ο μοριακός τύπος και οι δυνατοί συντακτικοί τύποι του αλκενίου.
Σημείωση: Το μήνυμα αυτό γράφτηκε 10 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Τυφών
Εκκολαπτόμενο μέλος


C2H2 + Br2 --> C2H2Br2
C2H6 + Br2--> C2H5Br +HBr
Όμως η άσκηση λέει ότι ένα από τα 2 δεν αντιδρά, λογικά το αιθάνιο αλλά γιατί; δεν είναι αντίδραση υποκατάστασης όπως π.χ. CH4 + Cl2 --> CH3 + HCl που έχει το βιβλίο;
Σημείωση: Το μήνυμα αυτό γράφτηκε 9 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Sommerfeld
Δραστήριο μέλος


Χρειαζομαι μια βοηθεια στις παρακατω ασκησεις του σχολικου βιβλιου, με επεξηγηση των λυσεων αν γινεται
64 Μίγμα όγκου 15 mL που αποτελείται από μεθάνιο και προπένιο αναφλέγεται με οξυγόνο. Μετά τη ψύξη των αερίων της καύσης στη συνήθη θερμοκρασία, βρίσκουμε ότι ο όγκος του αερίου που δεσμεύθηκε από διάλυμα NaOH είναι 35 mL. Αν οι όγκοι μετρήθηκαν στις
ίδιες συνθήκες θερμοκρασίας και πίεσης, να προσδιοριστεί η κατ' όγκον σύσταση του μίγματος των δύο υδρογονανθράκων.
65 Καίγονται 12 mL μίγματος αιθινίου και ενός υδρογονάνθρακα της ομόλογης σειράς των αλκανίων με 60 mL oξυγόνου. Μετά την καύση και την ψύξη των προϊόντων της καύσης στη συνήθη θερμοκρασία, απομένουν 51 mL, από τα οποία τα 26 mL δεσμεύτηκαν από διάλυμα βάσης. Να βρεθούν:
α) η κατ' όγκο σύσταση του μίγματος των δύο υδρογονανθράκων αν οι όγκοι μετρήθηκαν στις ίδιες συνθήκες θερμοκρασίας και πίεσης.
β) ο μοριακός τύπος του αλκανίου.
66.
10 mL αλκενίου υφίστανται πλήρη υδρογόνωση με 12 mL Η2 και μετατρέπονται σε αλκάνιο. Το μίγμα των αερίων που προκύπτει απαιτεί για την πλήρη καύση του 66 mL O2. Να βρεθεί ο μοριακός τύπος και οι δυνατοί συντακτικοί τύποι του αλκενίου.
Αν και εντελώς καθυστερημενα ειπα να τις δω τις ασκησεις σου(κυριως για να δω αν και εγω τα θυμαμαι καθως η χημεια μου αρεζε παρα πολυ)
64) Όταν έχουμε ΟΠΟΙΟΔΗΠΟΤΕ μείγμα (οργανικών ενωσεων, αεριων κλπ) πάντοτε λέμε "έστω χ η ποσοστητα(moles) της μιας ουσιας, έστω y τα moles της άλλης ουσιας κοκ"...Επειδή όμως στα αερία(στις ιδιες συνθηκες P, T) η αναλογια moles είναι ίδια με την αναλογία των όγκων τους μπορουμε κατευθειαν να δουλέψουμε με mL(έστω ότι έχουμε x mL CH4 και y mL C3H6)...Πάντοτε σε ασκήσεις με μείγματα ξέρουμε αυτομάτως ότι πρέπει να φτιαξουμε ένα γραμμικό σύστημα(δηλ. δύο εξισωσεις με τους αγνωστους που μολις ορισαμε)!! Την πρώτη εξισωση την ξερουμε ηδη ( VCH4 + VC3H6= Vμειγματος=> χ+y=15 mL)...
Επειτα γραφουμε τις χημικες εξισωσεις(δεν ειναι απαραιτητο, αλλα αν τα εχεις στο μυαλο σου μπορει να μπερδευτεις)...
CH4 + 2O2-> CO2 + 2H2O
xmL xmL
C3H6 + 9/2 O2-> 3CO2 + 3H2O
ymL 3ymL
Ακολουθει ψυξη οπότε οι αεριοι υδρατμοι υγροποιούνται(δεν μας ενδιαφερουν πια), οποτε το ΜΟΝΟ αεριο που απομενει ειναι το CO2 που εχει ογκο x+3y mL...Το CO2 δεσμευεται απο το NAOH(γιατι ειναι ο ανυδριτης του ανθρακικου οξεος, αν θυμασαι απο περυσι στα οξινα οξειδια= CO2+2NAOH->NA2CO3 +H2O), οπότε : x+3y=35mL
x + y =15
x + 3y= 35 Λύνεις το γραμμικό συστημα με την μεθοδο των αντιθετων συντελεστων(θα λυθει πιο γρηγορα ετσι) και βρίσκεις ότι ο ογκος του μεθανιου (χ) είναι 5mL και ο όγκος του προπενιου(y) 10 mL

65) Έχουμε λοιπόν 12mL αεριου μειγματος C2H2 ΚΑΙ CvH2v+2(τύπος αλκανιων), oπότε παρατηρουμε οτι εχουμε τρεις διαφορετικους αγνωστους(οι όγκοι των δύο υδρογονανθρακων συν το ν απο τον τυπο του αλκανιου), οπότε θα χρειαστει να βρουμε τρεις διαφορετικες εξισωσεις για να λυσουμε την ασκηση...Έστω χ mL C2H2 και ymL CvH2v+2(όπως σε καθε ασκηση με αερια μειγματα)!
Είπαμε ότι με την ψύξη του αεριου μειγματος υγροποιούνται οι υδρατμοι, οπότε δεν μας ενδιαφερουν στην υπολοιπη ασκηση....
Τα μόνα αερια που δεσμευονται απο δμ βασης ειναι τα οξινα οξειδια, δηλαδη εν πρκειμένω το CO2...Άρα VCO2= 26mL! Μας λέει ότι είχαμε όμως 51mL αεριων προϊοντων(εκ των οποιων τα 26 δεσμευτηκαν), άρα προφανως(και αφου δεν υπαρχουν πια H2O) ΕΊΧΑΜΕ περίσσεια O2, δηλαδη Vπερίσσειας= 51-26mL=25mL=> VO2αντεδρασε= 60-25mL=35mL
C2H2 + 5/2 O2=> 2CO2 + H2O
χ mL 2,5xmL 2xmL
CvH2v+2 + (3v + 1)/2 O2-> vCO2 + (v + 1)H2O
ymL (1,5v + 0,5)y mL vymL
x + y= 12
2,5x + (1,5v + 0,5)y = 35
2x + vy= 26
Λύνοντας το συστημα με αντικατασταση σε καθε μια σχεση βρισκουμε οτι: χ=10 mL και y= 2 mL
Επίσης απο το ιδιο συστημα βρισκουμε οτι ν=3, άρα CvH2v+2=>C3H8(προπανιο)
66) Mέθοδος καταλυτικής υδρογόνωσης: CvH2v + H2-> CvH2v+2
Άρα συμπεραινουμε ότι παραχθηκαν 10mL αλκανιου και περίσσεψαν 2mL Η2
2H2 + O2 -> 2H2O
2mL 1mL
CvH2v+2 + (3v+1)/2 O2-> vCO2 + (v+1)H2O
10mL 15v+5 mL
Άρα: Vo2= 1 + 15v + 5 mL=> 66=15v +6=> v=4=>C4H10(αλκανιο) και C4H8(αλκενιο)
Υπάρχουν 3 δυνατοί συντακτικοι τυποι: 1ος) CH2=CH-CH2-CH3 (1-προπένιο)
2ος) CH3-CH=CH-CH3 (2-προπένιο)
3ος) Με διακλάδωση=> μέθυλοπροπενιο (δεν μπορώ να την γράψω στο pc)
Έχουμε λέει μίγμα C2H2 και C2H6 το οποίο το διαβιβάζουμε σε περίσσεια διαλύματος Br2 σε CCl4. Εγώ λέω ότι γίνονται οι εξής αντιδράσεις;
C2H2 + Br2 --> C2H2Br2
C2H6 + Br2--> C2H5Br +HBr
Όμως η άσκηση λέει ότι ένα από τα 2 δεν αντιδρά, λογικά το αιθάνιο αλλά γιατί; δεν είναι αντίδραση υποκατάστασης όπως π.χ. CH4 + Cl2 --> CH3 + HCl που έχει το βιβλίο;
Να θυμάσαι ότι ο απλός ομοιοπολικός δεσμός αναμεσα στους δύο ανθρακες είναι πολύ σταθερός και για αυτό τα αλκάνια είναι σχετικά αδρανείς ενώσεις(θα τα δεις αναλυτικοτερα και στην γ λυκειου αν πας κατευθυνση), δίνουν λίγες μόνο αντιδρασεις(καυση, πυρόλυση, υποκατασταση) και αυτός ακριβως είναι ο λόγος που υπάρχουν σε αφθονία στην φύση(πχ στο βιοαεριο που προκυπτει απο την σήψη της βιομάζας υπάρχει πάρα πολύ περιεκτικοτητα σε μεθανιο)....Οπότε τα αλκάνια αν διαβιβαστούν σε δμ Br2 σε CCL4 δεν μπορούν να αντιδράσουν σε τόσο ήπιες συνθηκες και αυτο το καταλαβαινουμε πρακτικά αφού το δμ παραμενει καστανερυθρο...Ενώ στα αλκενια οι δύο ομοιοπολικοι δεσμοι αναμεσα στα ατομα ανθρακα ΔΕΝ ειναι ιδιοι(ισοτιμοι), ο ένας είναι ισχυρός και δυσκολα διασπαται(ο απλος δεσμος) και ο δευτερος διασπαται σχετικα ευκολα, οπότε θα υπαρξει αντιδραση του αλκενιου σε αυτο το δμ και αν υπαρξει στοιχειομετρικη αναλογια το δμ αποχρωμματιζεται...

Σημείωση: Το μήνυμα αυτό γράφτηκε 9 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Τυφών
Εκκολαπτόμενο μέλος


Αν και εντελώς καθυστερημενα ειπα να τις δω τις ασκησεις σου(κυριως για να δω αν και εγω τα θυμαμαι καθως η χημεια μου αρεζε παρα πολυ)
64) Όταν έχουμε ΟΠΟΙΟΔΗΠΟΤΕ μείγμα (οργανικών ενωσεων, αεριων κλπ) πάντοτε λέμε "έστω χ η ποσοστητα(moles) της μιας ουσιας, έστω y τα moles της άλλης ουσιας κοκ"...Επειδή όμως στα αερία(στις ιδιες συνθηκες P, T) η αναλογια moles είναι ίδια με την αναλογία των όγκων τους μπορουμε κατευθειαν να δουλέψουμε με mL(έστω ότι έχουμε x mL CH4 και y mL C3H6)...Πάντοτε σε ασκήσεις με μείγματα ξέρουμε αυτομάτως ότι πρέπει να φτιαξουμε ένα γραμμικό σύστημα(δηλ. δύο εξισωσεις με τους αγνωστους που μολις ορισαμε)!! Την πρώτη εξισωση την ξερουμε ηδη ( VCH4 + VC3H6= Vμειγματος=> χ+y=15 mL)...
Επειτα γραφουμε τις χημικες εξισωσεις(δεν ειναι απαραιτητο, αλλα αν τα εχεις στο μυαλο σου μπορει να μπερδευτεις)...
CH4 + 2O2-> CO2 + 2H2O
xmL xmL
C3H6 + 9/2 O2-> 3CO2 + 3H2O
ymL 3ymL
Ακολουθει ψυξη οπότε οι αεριοι υδρατμοι υγροποιούνται(δεν μας ενδιαφερουν πια), οποτε το ΜΟΝΟ αεριο που απομενει ειναι το CO2 που εχει ογκο x+3y mL...Το CO2 δεσμευεται απο το NAOH(γιατι ειναι ο ανυδριτης του ανθρακικου οξεος, αν θυμασαι απο περυσι στα οξινα οξειδια= CO2+2NAOH->NA2CO3 +H2O), οπότε : x+3y=35mL
x + y =15
x + 3y= 35 Λύνεις το γραμμικό συστημα με την μεθοδο των αντιθετων συντελεστων(θα λυθει πιο γρηγορα ετσι) και βρίσκεις ότι ο ογκος του μεθανιου (χ) είναι 5mL και ο όγκος του προπενιου(y) 10 mL
65) Έχουμε λοιπόν 12mL αεριου μειγματος C2H2 ΚΑΙ CvH2v+2(τύπος αλκανιων), oπότε παρατηρουμε οτι εχουμε τρεις διαφορετικους αγνωστους(οι όγκοι των δύο υδρογονανθρακων συν το ν απο τον τυπο του αλκανιου), οπότε θα χρειαστει να βρουμε τρεις διαφορετικες εξισωσεις για να λυσουμε την ασκηση...Έστω χ mL C2H2 και ymL CvH2v+2(όπως σε καθε ασκηση με αερια μειγματα)!
Είπαμε ότι με την ψύξη του αεριου μειγματος υγροποιούνται οι υδρατμοι, οπότε δεν μας ενδιαφερουν στην υπολοιπη ασκηση....
Τα μόνα αερια που δεσμευονται απο δμ βασης ειναι τα οξινα οξειδια, δηλαδη εν πρκειμένω το CO2...Άρα VCO2= 26mL! Μας λέει ότι είχαμε όμως 51mL αεριων προϊοντων(εκ των οποιων τα 26 δεσμευτηκαν), άρα προφανως(και αφου δεν υπαρχουν πια H2O) ΕΊΧΑΜΕ περίσσεια O2, δηλαδη Vπερίσσειας= 51-26mL=25mL=> VO2αντεδρασε= 60-25mL=35mL
C2H2 + 5/2 O2=> 2CO2 + H2O
χ mL 2,5xmL 2xmL
CvH2v+2 + (3v + 1)/2 O2-> vCO2 + (v + 1)H2O
ymL (1,5v + 0,5)y mL vymL
x + y= 12
2,5x + (1,5v + 0,5)y = 35
2x + vy= 26
Λύνοντας το συστημα με αντικατασταση σε καθε μια σχεση βρισκουμε οτι: χ=10 mL και y= 2 mL
Επίσης απο το ιδιο συστημα βρισκουμε οτι ν=3, άρα CvH2v+2=>C3H8(προπανιο)
66) Mέθοδος καταλυτικής υδρογόνωσης: CvH2v + H2-> CvH2v+2
Άρα συμπεραινουμε ότι παραχθηκαν 10mL αλκανιου και περίσσεψαν 2mL Η2
2H2 + O2 -> 2H2O
2mL 1mL
CvH2v+2 + (3v+1)/2 O2-> vCO2 + (v+1)H2O
10mL 15v+5 mL
Άρα: Vo2= 1 + 15v + 5 mL=> 66=15v +6=> v=4=>C4H10(αλκανιο) και C4H8(αλκενιο)
Υπάρχουν 3 δυνατοί συντακτικοι τυποι: 1ος) CH2=CH-CH2-CH3 (1-προπένιο)
2ος) CH3-CH=CH-CH3 (2-προπένιο)
3ος) Με διακλάδωση=> μέθυλοπροπενιο (δεν μπορώ να την γράψω στο pc)
Να θυμάσαι ότι ο απλός ομοιοπολικός δεσμός αναμεσα στους δύο ανθρακες είναι πολύ σταθερός και για αυτό τα αλκάνια είναι σχετικά αδρανείς ενώσεις(θα τα δεις αναλυτικοτερα και στην γ λυκειου αν πας κατευθυνση), δίνουν λίγες μόνο αντιδρασεις(καυση, πυρόλυση, υποκατασταση) και αυτός ακριβως είναι ο λόγος που υπάρχουν σε αφθονία στην φύση(πχ στο βιοαεριο που προκυπτει απο την σήψη της βιομάζας υπάρχει πάρα πολύ περιεκτικοτητα σε μεθανιο)....Οπότε τα αλκάνια αν διαβιβαστούν σε δμ Br2 σε CCL4 δεν μπορούν να αντιδράσουν σε τόσο ήπιες συνθηκες και αυτο το καταλαβαινουμε πρακτικά αφού το δμ παραμενει καστανερυθρο...Ενώ στα αλκενια οι δύο ομοιοπολικοι δεσμοι αναμεσα στα ατομα ανθρακα ΔΕΝ ειναι ιδιοι(ισοτιμοι), ο ένας είναι ισχυρός και δυσκολα διασπαται(ο απλος δεσμος) και ο δευτερος διασπαται σχετικα ευκολα, οπότε θα υπαρξει αντιδραση του αλκενιου σε αυτο το δμ και αν υπαρξει στοιχειομετρικη αναλογια το δμ αποχρωμματιζεται...
Σε ευχαριστώ πολύ για τον χρόνο που αφιέρωσες και ασχολήθηκες..όμως στο CH4 + Cl2 --> CH3Cl + HCl που έχει το βιβλίο δεν είναι το ίδιο; είναι αντίδραση υποκατάστασης αλκανίων..ή παίζει ρόλο αν είναι Cl2, Br2, F2 κτλ; γιατί δηλαδή να μην γίνεται και αυτό: C3H8 + Cl2 --> C3H7Cl + HCl; (προπάνιο+χλώριο-->χλωροπροπάνιο+υδροχλώριο) και δεν νομίζω να παίζουν ρόλο οι καταλύτες για κάθε αντίδραση, σε όλες τις ασκήσεις τους θεωρούμε δεδομένους..
Σημείωση: Το μήνυμα αυτό γράφτηκε 9 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Sommerfeld
Δραστήριο μέλος


Σε ευχαριστώ πολύ για τον χρόνο που αφιέρωσες και ασχολήθηκες..όμως στο CH4 + Cl2 --> CH3Cl + HCl που έχει το βιβλίο δεν είναι το ίδιο; είναι αντίδραση υποκατάστασης αλκανίων..ή παίζει ρόλο αν είναι Cl2, Br2, F2 κτλ; γιατί δηλαδή να μην γίνεται και αυτό: C3H8 + Cl2 --> C3H7Cl + HCl; (προπάνιο+χλώριο-->χλωροπροπάνιο+υδροχλώριο) και δεν νομίζω να παίζουν ρόλο οι καταλύτες για κάθε αντίδραση, σε όλες τις ασκήσεις τους θεωρούμε δεδομένους..
Απο ότι είδα η υποκατάσταση είναι φωτοχημικη αντιδραση(πραγματοποιήται μόνο σε διάχυτο φως), δηλαδή απαιτεί αυτήν την ιδιαίτερη συνθήκη για να συμβεί σταδιακή αντικατασταση των ατόμων άνθρακα με κάποιο αλογόνο, όταν διαβιβάζεται σε κάποιο δμ λογικά δεν μπορεί να υπάρξει αυτή η συνθηκη. Πάντως να είσαι σίγουρος 200% ότι τα αλκάνια δεν μπορούν να αντιδράσουν μέσα σε δμ βρωμίου σε ccl4, μόνον τα αλκένια και τα αλκίνια μπορούν να το αποχρωματίσουν...
Σημείωση: Το μήνυμα αυτό γράφτηκε 9 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Meow
Νεοφερμένο μέλος


A) Ποια είναι η σύσταση του μίγματος;
Β) Το μίγμα διαβιβάζεται πάνω από καταλύτη Ni και θερμαίνεται. Ποια είναι η σύσταση του αερίου που προκύπτει;
Λοιπόν, έχω κολλήσει στο δεύτερο μέρος της άσκησης και δεν ξέρω τι να κάνω. Στο Α ερώτημα ενώ βρήκα τα μολ του καθενός, με έχει μπερδέψει λίγο καθώς δεν είναι ισομοριακό.. και αναρωτιέμαι δεν θα πρεπε να ήταν αφού έχουμε προσθήκη;; Μπορείτε να μου δώσετε καμία ιδέα στο τι θα κάνω στο β (δεν χρειάζεται να μου την λύσετε); Σας ευχαριστώ εκ των προτέρων

Σημείωση: Το μήνυμα αυτό γράφτηκε 7 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
xristianax
Εκκολαπτόμενο μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 7 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Nick890
Επιφανές μέλος


Δείτε το λίγο και απαντήστε πλήρες ( έχω την απάντηση αλλά ,διαφωνώ σε κάτι με τον καθηγητή του σχολείου )
Σημείωση: Το μήνυμα αυτό γράφτηκε 7 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Lancelot
Περιβόητο μέλος


Ποια έχει μεγαλύτερη ατομική ακτίνα ,στοιχείο με ατομικό αριθμό 11(Να) ή στοιχείο με ατομικό αριθμό 35(Βr);;;
Δείτε το λίγο και απαντήστε πλήρες ( έχω την απάντηση αλλά ,διαφωνώ σε κάτι με τον καθηγητή του σχολείου )
Αν και δεν τα θυμαμαι και πολυ καλα.
Η ατομικη ακτινα αυξάνει αριστερά και προς τα κάτω. Άρα το νατριο μεγαλυτερη ακτινα.
Μετα μπορεις να κανεις και ηλεκτρονιακη διαμορφωση , το νατριο έχει 1 ηλεκτρονιο στην εξ.στιβαδα ενω το βρωμιο 7 (αυτο ειναι και το δραστικο φορτιο), τα 7 ελκονται περισσοτερο απο τον πυρηνα.
Σημείωση: Το μήνυμα αυτό γράφτηκε 7 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Unseen skygge
Πολύ δραστήριο μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 7 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Chemwizard
Τιμώμενο Μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 7 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Unseen skygge
Πολύ δραστήριο μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 7 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Chemwizard
Τιμώμενο Μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 7 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Χρήστες Βρείτε παρόμοια
-
Τα παρακάτω 0 μέλη και 1 επισκέπτες διαβάζουν μαζί με εσάς αυτό το θέμα:Tα παρακάτω 8 μέλη διάβασαν αυτό το θέμα:
-
Φορτώνει...
-
Το forum μας χρησιμοποιεί cookies για να βελτιστοποιήσει την εμπειρία σας.
Συνεχίζοντας την περιήγησή σας, συναινείτε στη χρήση cookies στον περιηγητή σας.
 Αρχική Forum
Αρχική Forum
 Ρωτήστε κάτι
Ρωτήστε κάτι
 Προσωπικές Συζητήσεις
Προσωπικές Συζητήσεις
 Πανελλαδικές
Πανελλαδικές
 Αγγελίες
Αγγελίες
 Συνδεδεμένοι Χρήστες
Συνδεδεμένοι Χρήστες
 Λίστα Αποκλεισμένων
Λίστα Αποκλεισμένων
 Υπεύθυνοι του Forum
Υπεύθυνοι του Forum
 e-steki
e-steki



